Как готовится кляр
Все секреты правильного кляра - 25 рецептов для всех продуктов - Четыре вкуса
Как и многие изысканные блюда, кляр скорее всего придумали во Франции, да и слово на французском звучит именно так claire, что в переводе означает жидкий. Известно, что в Японии нечто подобное называется темпура. Самое забавное, что готовить темпуру японцев научили португальцы еще в 16-м веке. Распробовав европейский кляр, повара Востока превратили его в один из главных атрибутов японской кухни.
Самым распространенным и горячо любимым блюдом считаются отбивные в кляре из свинины или курицы. А кроме того, в кляре можно жарить сыр, куски сырой рыбы, мясо (предварительно отбитое), отбивные, котлеты, грибы, кальмаровые колечки, креветки, бараньи сваренные мозги, телячьи ножки, крокеты из риса и яиц, даже голубцы.
И, конечно, в кляре обжаривают овощи и фрукты. Цветная капуста, баклажаны, кабачки, тыква, сладкий перец и огурцы, помидоры колечками. Кружочки и ломтики яблок, груш, слив, целые вишни и черешни. А еще листья шпината, салата, щавеля, петрушки и сельдерея. Луковые колечки. Бананы. Только помните, что твердые овощи нужно заранее отварить до полуготовности.
Кляр — жидкое тесто, в которое обмакивают продукты перед их обжариванием. Для его приготовления муку смешивают с яйцами и разбавляют до кремообразной консистенции молоком либо другой жидкостью.
Другими словами, кляр представляет собой просто жидкую панировку : в полученную полужидкую смесь обмакивают кусочки продуктов и жарят их во фритюре, в результате чего продукты покрываются красивой аппетитной корочкой.В состав любого кляра обязательно входят мука, яйцо и какой либо наполнитель, как правило ароматный. Часто, для придания определенного вкуса, кляр готовят с использованием дрожжей.
Разводится кляр на воде (в простейшем случае) или молоке. Иногда вместо обычной воды используют минеральную или газированную воду. Но наиболее продвинутые повара зачастую используют другие жидкости, как то - , пиво, вино, водку, коньяк. В этих случаях выбор обычно делают в пользу сочетающегося с начинкой напитка, либо используют часть того же напитка, который будет подаваться с этим блюдом.
Например, ЕСЛИ ВЫ ГОТОВИТЕ КРЕВЕТКИ, КАЛЬМАРЫ ИЛИ ДРУГИЕ МОРЕПРОДУКТЫ В КЛЯРЕ, то уместно использовать пиво или белое вино. Если мясо - то красное вино или водку. Прекрасно подходят к применению в клярах домашние вина и настойки. Особенно ароматными получаются кляры на яблочных или сливовых винах.
В КАЧЕСТВЕ АРОМАТНЫХ НАПОЛНИТЕЛЕЙ ДЛЯ ПРИДАНИЯ ОПРЕДЕЛЕННОГО ВКУС ИСПОЛЬЗУЮТ сушеные и свежие мелкорубленные травы и пряности. Можно добавить в кляр (в густые вариации, жидкие не удержат) вкусовые добавки - пассерованный лук, грибы, болгарский перец, зелень. Главное - очень мелко нарезать.
Очень интересные оттенки вкуса можно получить, добавив, например, отварной картофель или тыкву, перетертые в пюре.
Можно также применить некоторые сорта ароматного твердого сыра, измельченные на терке.
Оригинальны кляры с молотым орехом (грецким, мускатным).
КЛЯР БЫВАЕТ СЛАДКИМ, ПРЕСНЫМ, СОЛЕНЫМ.
Искусство приготовления кляра состоит в правильной дозировке соотношения воды, муки и яиц и, особенно, в том, как смешиваются эти компоненты.
СЕКРЕТЫ ПРИГОТОВЛЕНИЯ КЛЯРА
• Готовят кляры путем тщательного перемешивания ингредиентов (при помощи венчика, миксера или просто вилкой) до однородного состояния кляра.
• К пропорциям продуктов, из которых делается кляр, можно и нужно подходить творчески. Важен порядок соединения, а также раздельное взбивание белка и желтка:
• Тесто для кляра (без белков) лучше готовить заблаговременно — если оно простоит 1 ч при комнатной температуре, то клейковина в муке потеряет эластичность, поэтому тесто лучше пристанет и не усохнет при контакте с горячим маслом.
• Взбитые белки. Взбитые белки придают кляру легкость и пышность, их следует прибавлять в тесто перед самым жареньем и сразу ставить кастрюлю с кляром в холодную воду.
• Прибавка пива или вина. Как уже говорилось, иногда в кляр вместо воды добавляют пиво или в водку для получения хрустящей корочки.
• Во многих рецептах указывается, что кляр обязательно должен быть холодным. Потому для его приготовления использовать нужно холодные жидкости, лучше всего, прямо-таки ледяные.
• Мало того, еще и выдержать готовый кляр не менее часа в холодильнике: жидкое тесто становится более однородным и эластичным.
• Здесь важен контраст температур. Холодный кляр и хорошо разогретый фритюр. И обжаривание в хорошо разогретом масле должно быть быстрым. Потому, обжариваемый продукт должен быть уже практически готовым.
• Главным показателем кляра является его вязкость. В зависимости от приготавливаемых продуктов и желаемой толщины корочки, кляр может быть густым или жидким:
- Жидкие кляры обыкновенно более легки и хрустящи, но пропускают в обжариваемый продукт слишком много масла. Это хорошо, если продукт «суховат».
- Густые кляры – более тяжеловесны, однако, они хорошо «прилипают» к поверхности продукта и создают для него замечательную пушистую хлебную оболочку. Такой кляр хорош для сочных продуктов. Я, например, для отварной цветной капусты предпочитаю, именно такой.
• Вязкость определяют по скорости стекания его с ложки. Чтобы проверить качество кляра, возьмите большую ложку и обмакните в посуду с кляром. Если кляр равномерно покрыл ложку и не просвечивается ее поверхность, значит кляр нужной консистенции.
• В этом процессе важны два момента – сцепление кляра с кусочком того, что вы жарите и нестекаемость кляра в процессе жарки.
СУЩЕСТВУЕТ НЕБОЛЬШИЕ ХИТРОСТИ:
1. Сцепление можно улучшить, если кусочек промокнуть до того, как опускать в кляр.
2. Чтобы кляр не стекал с продуктов, нужно продукты «подсушить»: для этого кусочки уложить на доску в один слой и припудрить через сито мукой или крахмалом, лучше рисовым, очень тонким слоем и лишь потом опускать в кляр. . На вкусе это не отразится, а кляр течь будет меньше.
3. Газированная минеральная вода — это один из секретов отличного кляра. Лучше, если такая вода будет не ароматизирована. Кляр получается воздушный, румяный и не жирный — всё дело в волшебных пузырьках!
4. Количество кляра для обжаривания продуктов рассчитать не сложно. Только следует помнить, что чем суше продукты, тем меньше нужно замешивать кляра для их обжарки.
Обычное соотношение это 1:1, т.е., например 200 г кляра и 200 г кусочков овощей, фруктов, мяса и т.д.
5. Все продукты обычно жарят во фритюре, животном или растительном жире, либо их смеси. Фритюр тщательно разогревают в толстостенной посуде, а затем в него поочередно опускаются кусочки продуктов в кляре. Если масла достаточно и оно хорошо разогрето, кляр «схватится» быстро и будет прекрасно держаться.
6. Масло должно быть хорошо разогрето, проверить температуру масла можно, капнув капельку жидкого теста. Если оно сразу «затанцевало», температура подходящая.
7. Продукт, жареный в кляре лучше выкладывать на тарелку с бумажной салфеткой, чтобы салфетка забрала лишний жир.
Если у вас есть фритюрница – жарьте в ней. Но на самом деле это не обязательное условие. Можно жарить на сковородке с толстым дном и высокими стенками в большом количестве масла.
И ещё один совет: при обжарке в кляре очень важно, как стоят ёмкости. Порядок должен быть таким (справа налево): миска с подготовленным продуктом, миска с кляром, фритюр, тарелка для готового. Всё на минимальном расстоянии, чтобы совершать минимум движений и кляр не успевал стечь.
25 РЕЦЕПТОВ КЛЯРА.
Существует множество рецептов кляра и вот некоторые из них.
1. КЛАССИЧЕСКИЙ РЕЦЕПТ КЛЯРА.
Такой вид кляра позволяет сохранить натуральный вкус продукта, а корочка получается красивого золотистого цвета.
яйцо -4 шт.
пшеничная мука - 125 г,
масло растительное - 0.5 ст. л.
кипяченая вода - 0.5 стакана.
соль - по вкусу
Отделяем белки от желтков. Это очень важно при приготовлении кляра, когда белки взбиваются отдельно и добавляются в общую массу в процессе приготовления.
Белки отправляем в холодильник.
В отдельной миске соединяем желтки, масло и теплую воду, хорошо перемешиваем. Добавляем соль по вкусу ( немного)
Просеиваем муку для того, чтобы кляр получился воздушным.
В желтковую смесь всыпаем по-немногу муку и размешиваем венчиком.
Как только смесь станет однородной, нужно добавить взбитые белки.
Для этого достаем из холодильника яичные белки. Посыпаем щепоткой соли и взбиваем их миксером до воздушной пены.
Соединяем взбитые белки с тестом.
Совет: Не следует добавлять сразу всю взбитую массу в тесто,
Лучше вводить небольшими порциями, тщательно размешивая тесто
Готовый кляр охлаждаем.
Полученный кляр лучше держать в мисочке, поставленной в холодную воду.
Можно использовать не простую, а минеральную воду. Получается очень вкусно и нежно.
Для экстремалов: вместо простой воды вы можете использовать "колу" или "фанту". Первый вариант придает готовому блюду ореховый привкус, а второй - слегка цитрусовый. Во втором случае кляр будет изумительного оранжевого оттенка.
Французы изобрели кляр на ледяном светлом пиве. Светлые сорта пива предпочитаются потому, что они не дают лишней горечи. Такой кляр будет более нежным и хрустящим! Есть два способа приготовления пивного кляра – с яйцами и без них.
2. КЛЯР НА ПИВЕ (БЕЗ ЯИЦ)
Мука пшеничная - 250 гр
Пиво - 500 гр
Петрушка - по вкусу
Перец черный - по вкусу
Куркума - 3 гр
соль - по вкусу
В посуду для приготовления кляра добавляем муку, черный перец и куркуму.
Далее добавляем пиво и мелко нарезанную зелень петрушки.
Все взбиваем миксером до однородной массы.
3. КЛЯР ПИВНОЙ
125 грамм просеянной муки,
соль по вкусу,
1/8 литра светлого пива,
2 яичных желтка,
40 грамм сливочного масла,
2 яичных белка.
Для начала просеиваем муку, затем понемногу вливаем в муку тёплое светлое пиво, непрерывно помешивая до образования однородной массы. После этого добавляем к получившейся массе сливочное масло, 2 яичных белка и соль по вашему вкусу, всё тщательно перемешиваем.
4. КЛЯР ПИВНОЙ БЕЗ ЯИЦ КЛАССИЧЕСКИЙ
Такой кляр готовится очень просто в пропорции один к одному - 1 стакан муки на 1 стакан пива. Можно добавить соль и перец по вкусу.
Вначале в пиво добавьте соль и перец. Потом постепенно вмешайте муку. Тесто должно получиться не капающим, а тянущимся. Но если будет очень густо можно капнуть еще пива до нужной консистенции.
5. КЛЯР С ПИВОМ ИЛИ ВИНОМ
Этот кляр подходит для морепродуктов и рыбы
1 куриное яйцо
100 гр. Муки
Специи по вкусу
Пиво или вино до необходимой консистенции.
6. КЛЯР С ВОДКОЙ И ВИНОМ
Для различных видов мяса. Если готовится говядина или баранина, то белое вино можно заменить красным.
1 яичный желток
50-100 гр. Муки
Специи по вкусу.
20 граммов водки
Белое вино или пиво до нужной консистенции.
7. КАРТОФЕЛЬНЫЙ КЛЯР.
картофель - 3шт
яйцо - 1шт
мука - 2 ст.л.
соль - по вкусу
Три крупных клубня картофеля почистить и натереть на крупной терке. Добавить одно яйцо, две столовые ложки муки. Солло вкусу. Продукт для обжарки (например, рыбу) запанировать в картофельной «подушке», крепко прижимая кляр и обжарить с двух сторон.
8. КЛЯР ПО-КИТАЙСКИ.
яйцо - 1 шт
крахмал кукурузный - 2 ст.л.
соль - по вкусу
Смешиваем взбитое яйцо, кукурузный крахмал и соль. Продукты обмакиваем в этот кляр и на очень сильном огне быстро обжариваем. Кстати, в этом кляре очень вкусно получаются замаринованные куриные крылышки.
9. СЫРНЫЙ КЛЯР.
2-3 столовые ложки майонеза,
4 яйца,
100 г твердого сыра.
соль - по вкусу
Сыр натереть на мелкой терке. Смешать с майонезом и яйцами. Вмешать соль, перец и 4 столовые ложки муки.
Продукты в этом кляре получаются очень сытными и вкусными.
10. КЛЯР С СЫРОМ
1 куриное яйцо
1 чайная ложка сушеной зелени в порошке
100 гр белого сухого вина
1 столовая ложка тертого пармезана
соль и перец по вкусу
Мука до нужной консистенции
Сыр натереть на терке, добавить яйцо, вино, специи и соль-перец по вкусу. всё хорошо перемешать. Добавить муку до нужной консистенции.
11. КЛЯР СО СМЕТАНОЙ И СЫРОМ
2 яйца,
3 ст. ложки сметаны,
соль и сахар по вкусу,
мука - 4-6 ст. л.
Сыр натрите на мелкой тёрке Отделите белки от желтков. Белки взбейте.
Муку смешайте с желтками, посолите, добавьте сахара, сметану. Мелко натертый твердый сыр нужно ввести в массу до того, как добавите белки. И в конце – смешайте с белками. Добавлять их нужно осторожно, постоянно помешивая, чтобы не осели
Но тут есть дополнительное условие:
*Белки перед тем, как взбивать, нужно особенно тщательно охладить, лучше даже поставить в морозилку на минут пять. Только следите, чтобы они не промерзли! После этого их легче будет взбивать, и они выдержать тяжесть сыра.
12. БЕЛКОВЫЙ КЛЯР.
Самый нежный из всех предложенных.
4-5 белков.
мука - 2-3 ст.л.
вода
соль - по вкусу
Белки хорошо взбивают с солью Добавляют 2-3 столовые ложки муки и немного воды, чтобы получилась смесь, как на жидкие блины. Продукты обмакивают в эту нежность. Обжаривают. Наслаждение!
13. КЛЯР С ОРЕХАМИ:
1 куриное яйцо
50-100 гр. молотых орехов
1 чайная ложка сушеной зелени в порошке
100 гр белого сухого вина
Специи по вкусу
Мука до нужной консистенции.
Орехи (миндальные, грецкие) растереть в крошку - они обязательно должны быть довольно мелко измельчены. . Яйцо смешать с вином, подсыпать орехи, Перемешивая, подсыпать муку. Добавить специи.
14. МОЛОЧНЫЙ КЛЯР
Подходит для приготовления фруктов.
яйцо - 3 шт.,
молоко - 6 ст. л,
масло растительное - 1 ч. л,
мука пшеничная - 125 г,
сахар по вкусу.
Взбиваем миксером белки до образования белой пены. Смешиваем в емкости желтки, масло, муку и молоко. Солим по вкусу. Взбиваем смесь до однородной массы и аккуратно вливаем белки.
До введения белков можно добавить немного разрыхлителя. Это позволит кляру стать совершенно воздушным.
15. КЛЯР НА МОЛОКЕ
молоко - 400 г.
яйца - 6 шт.
растительно масло - 2 ст.л.
мука - 400 г.
Разделить желтки и белки. В теплое молоко вбиваются яичные желтки, добавляется соль, немного растительного масла, мука и замешивается негустое тесто. Затем вводят в него взбитые в крепкую пену белки и осторожно перемешивают. Этого количества кляра хватит, например, на 1,5 кг рыбного филе.
16. КЛЯР НА СМЕТАНЕ
пол стакана сахара
1стакан муки
3 яйца
пол стакана сметаны
соль по вкусу
Отделяем желтки от белков, взбиваем белки. Смешиваем желтки ,муку, сахар и сметану., солим. Соединяем постепенно взбитые белки с тестом, тщательно размешивая тесто
Можно ввести вместо сметаны - йогурт. Особенно пикантным кляр получается с фруктовым йогуртом, причем использовать такой кляр можно не только для фруктов, но и для мяса и рыбы.
17. КЛЯР НА МАЙОНЕЗЕ
Майонез 2 ст. ложки
Яйца 2-3 шт
Мука 3-4 ст. ложки
Приправы и соль - по вкусу
Разотрите яйца с майонезом, добавьте приправы, соль-перец по вкусу. Затем добавте муки до густоты сметаны
18. КЛЯР СО СЛИВКАМИ И САХАРОМ
Этот кляр очень плотный. Он позволяет полностью сохранить вкус продукта.
3 яичных желтка,
пол стакана жирных сливок,
соль, сахар,
мука – сколько войдет.
Разотрите яичные желтки с солью, смешайте со сливками. Можно добавить чуть-чуть сахара. При помешивании досыпьте муку. Консистенция должна быть как у жидкой сметаны.
19. КЛЯР НА МИНЕРАЛЬНОЙ ВОДЕ
Минеральная вода делает кляр более рыхлым, ноздреватым, воздушным.
Яйцо – 4 шт.
Мука – 1-1,5 стакана
Молоко, сливки или кефир – 0,5 стакана
Минеральная вода – 0,5 стакана
Соль, сахар, перец черный молотый – по вкусу
Для начала отделим белки от желтков.
Желтки растираем с солью и сахаром ( примерно, 1/2 ч. ложки соли и 1 ч. ложка сахара), добавляем немного черного перца ( на любителя), далее добавляем минеральную воду и молоко (или сливки, кефир). Все это тщательно перемешиваем.
Белки (предварительно охлажденные) взбиваем в густую пену миксером (2-2,5 минуты). Тонкой струйкой добавляем взбитые белки в уже почти готовую смесь.
Источник
Как работают батареи? | Живая наука
Батарейки везде. Современный мир зависит от этих портативных источников энергии, которые можно найти во всем: от мобильных устройств до слуховых аппаратов и автомобилей.
Но, несмотря на то, что они широко используются в повседневной жизни людей, батареям часто не уделяют должного внимания. Подумайте об этом: вы действительно знаете, как работает аккумулятор? Не могли бы вы объяснить это кому-нибудь другому?
Вот краткое изложение научных данных об источниках энергии для смартфонов, электромобилей, кардиостимуляторов и многого другого.[Тест: электрические и газовые автомобили]
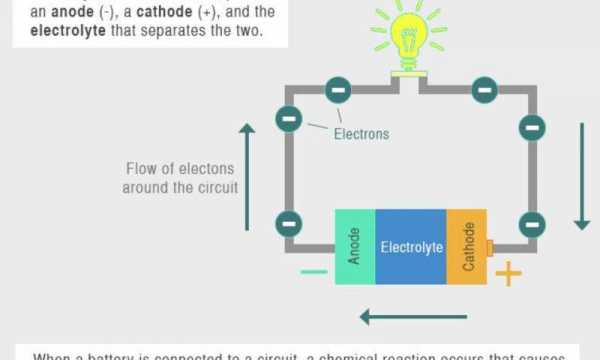
Анатомия аккумулятора
Большинство аккумуляторов содержат три основные части: электроды, электролит и сепаратор, по словам Энн Мари Састри, соучредителя и генерального директора Sakti3, базирующейся в Мичигане. запуск аккумуляторных технологий.
В каждой батарее по два электрода. Оба изготовлены из токопроводящих материалов, но выполняют разные функции. Один электрод, известный как катод, подключается к положительному концу батареи и является местом, где электрический ток выходит (или электроны входят) в батарею во время разряда, то есть когда батарея используется для питания чего-либо.Другой электрод, известный как анод, подключается к отрицательному полюсу батареи и является местом, где электрический ток входит (или электроны покидают) батарею во время разряда.
Между этими электродами, а также внутри них находится электролит. Это жидкое или гелеобразное вещество, содержащее электрически заряженные частицы или ионы. Ионы соединяются с материалами, из которых состоят электроды, производя химические реакции, которые позволяют батарее генерировать электрический ток.[Взгляд изнутри на работу батарей (инфографика)]
Типичные батареи питаются за счет химической реакции. [См. Полную инфографику] (Изображение предоставлено Карлом Тейтом, художником по инфографике)
Последняя часть батареи, разделитель, довольно проста. Роль сепаратора состоит в том, чтобы удерживать анод и катод отдельно друг от друга внутри батареи. По словам Састри, без разделителя два электрода соприкоснутся, что приведет к короткому замыканию и нарушит нормальную работу батареи.
Как это работает
Чтобы представить себе, как работает батарейка, представьте, как вы вставляете щелочные батарейки, такие как двойные AA, в фонарик. Когда вы вставляете эти батарейки в фонарик, а затем включаете его, на самом деле вы замыкаете цепь. Накопленная в батарее химическая энергия преобразуется в электрическую, которая выходит из батареи в основание лампы фонарика, заставляя ее загораться. Затем электрический ток снова входит в батарею, но на противоположном конце от того места, где он выходил изначально.
Все части батареи работают вместе, чтобы фонарик загорался. Электроды в батарее содержат атомы определенных проводящих материалов. Например, в щелочной батарее анод обычно изготавливается из цинка, а диоксид марганца действует как катод. Электролит между электродами и внутри них содержит ионы. Когда эти ионы встречаются с атомами электродов, между ионами и атомами электродов происходят определенные электрохимические реакции.
Серия химических реакций, протекающих в электродах, известна как окислительно-восстановительные (окислительно-восстановительные) реакции.В батарее катод известен как окислитель, потому что он принимает электроны от анода. Анод известен как восстановитель, потому что он теряет электроны.
В конечном итоге эти реакции приводят к потоку ионов между анодом и катодом, а также к освобождению электронов от атомов электрода, - сказал Састри.
Эти свободные электроны собираются внутри анода (нижняя плоская часть щелочной батареи). В результате два электрода имеют разные заряды: анод становится отрицательно заряженным, когда высвобождаются электроны, а катод становится положительно заряженным, поскольку электроны (которые заряжены отрицательно) поглощаются.Эта разница в заряде заставляет электроны двигаться к положительно заряженному катоду. Однако у них нет возможности попасть внутрь батареи, потому что разделитель не позволяет им сделать это.
Когда вы щелкаете выключателем фонарика, все меняется. У электронов теперь есть путь к катоду. Но сначала они должны пройти через основание лампы фонарика. Схема замыкается, когда электрический ток снова входит в батарею через верхнюю часть батареи у катода.
Перезаряжаемые и неперезаряжаемые
Для первичных батарей, таких как батареи фонарика, реакции, питающие батарею, в конечном итоге прекратятся, а это означает, что электроны, которые обеспечивают батарею ее зарядом, больше не будут создавать электрический ток. Когда это происходит, аккумулятор разряжен или «мертв», - сказал Састри.
Вы должны выбросить такие батареи, потому что электрохимические процессы, которые заставили батарею производить энергию, не могут быть обращены вспять, объяснил Састри.Однако электрохимические процессы, происходящие во вторичных или перезаряжаемых батареях, могут быть обращены вспять путем подачи электроэнергии в батарею. Например, это происходит, когда вы подключаете аккумулятор мобильного телефона к зарядному устройству, подключенному к источнику питания.
Некоторые из наиболее распространенных используемых сегодня вторичных батарей - это литий-ионные (литий-ионные) батареи, от которых питается большинство бытовых электронных устройств. Эти батареи обычно содержат угольный анод, катод из диоксида лития-кобальта и электролит, содержащий соль лития в органическом растворителе.Другие перезаряжаемые батареи включают никель-кадмиевые (NiCd) и никель-металл-гидридные (NiMH) батареи, которые можно использовать в таких вещах, как электромобили и аккумуляторные электроинструменты. Свинцово-кислотные (Pb-кислотные) батареи обычно используются в автомобилях и других транспортных средствах для запуска, освещения и зажигания.
По словам Састри, все эти аккумуляторные батареи работают по одному и тому же принципу: когда вы подключаете батарею к источнику питания, поток электронов меняет направление, и анод и катод возвращаются в исходное состояние.[10 лучших подрывных технологий]
Battery lingo
Хотя все батареи работают более или менее одинаково, разные типы батарей имеют разные характеристики. Вот несколько терминов, которые часто встречаются при любом обсуждении батарей:
Напряжение : Когда дело доходит до батарей, напряжение - также известное как номинальное напряжение ячейки - описывает величину электрической силы или давления, при которой свободные электроны - переходите от положительного полюса батареи к отрицательному, - объяснил Састри.В батареях с более низким напряжением ток выходит из батареи медленнее (с меньшей электрической силой), чем в батареях с более высоким напряжением (с большей электрической силой). Батареи в фонарике обычно имеют напряжение 1,5 В. Однако, если в фонарике используются две батареи последовательно, эти батареи или элементы имеют общее напряжение 3 вольта.
Свинцово-кислотные батареи, подобные тем, которые используются в большинстве неэлектрических автомобилей, обычно имеют напряжение 2,0 вольт. Но обычно в автомобильном аккумуляторе последовательно соединено шесть таких ячеек, поэтому вы, вероятно, слышали, что такие батареи называются 12-вольтовыми батареями.
Литий-кобальтооксидные батареи - наиболее распространенный тип литий-ионных батарей, используемых в бытовой электронике, - имеют номинальное напряжение около 3,7 вольт, сказал Састри.
Ампер : Ампер или ампер - это мера электрического тока или количества электронов, которые проходят через цепь в течение определенного периода времени.
Емкость : Емкость или емкость элемента измеряется в ампер-часах, то есть количество часов, в течение которых батарея может подавать определенное количество электрического тока, прежде чем ее напряжение упадет ниже определенного порога, согласно сообщению Райса. Кафедра электротехники и вычислительной техники университета.
9-вольтовая щелочная батарея, используемая в портативных радиоприемниках, рассчитана на 1 ампер-час, что означает, что эта батарея может непрерывно подавать один ампер тока в течение 1 часа, прежде чем она достигнет порогового значения напряжения и будет считаться разряженной.
Плотность мощности : Плотность мощности описывает количество энергии, которое батарея может выдать на единицу веса, сказал Састри. По словам Састри, для электромобилей важна плотность мощности, потому что она показывает, насколько быстро автомобиль может разгоняться от 0 до 60 миль в час (97 км / ч).Инженеры постоянно пытаются найти способы уменьшить размеры батарей без снижения их удельной мощности.
Плотность энергии : Плотность энергии описывает, сколько энергии способна отдавать батарея, деленное на ее объем или массу, сказал Састри. Это число соответствует вещам, которые имеют большое влияние на пользователей, например, сколько времени вам нужно пройти, прежде чем зарядить мобильный телефон, или как далеко вы можете проехать на электромобиле, прежде чем остановиться, чтобы подключить его.
Follow Elizabeth Palermo @ techEpalermo .Следуйте за Live Science @livescience , Facebook и Google+ .
Дополнительные ресурсы
.История развития аккумуляторов
 Аккумуляторы прошли долгий путь с момента их появления в 250 г. до н.э. Предоставлено: Flickr / Patty, CC BY-NC-SA.
Аккумуляторы прошли долгий путь с момента их появления в 250 г. до н.э. Предоставлено: Flickr / Patty, CC BY-NC-SA. Батареи сегодня настолько распространены, что они почти невидимы для нас. Тем не менее, это замечательное изобретение с долгой и легендарной историей и не менее интересным будущим.
Батарея - это, по сути, устройство, в котором накапливается химическая энергия, которая преобразуется в электричество.По сути, батареи - это небольшие химические реакторы, в которых в результате реакции образуются энергичные электроны, готовые протекать через внешнее устройство.
Батарейки у нас давно. В 1938 году директор Багдадского музея обнаружил в подвале музея то, что сейчас называют «Багдадской батареей». Анализ датировал его примерно 250 г. до н.э. и датировал его месопотамским происхождением.
Противоречие окружает этот самый ранний пример батареи, но предлагаемые варианты использования включают гальваническое покрытие, обезболивание или религиозное покалывание.
Американский ученый и изобретатель Бенджамин Франклин впервые использовал термин «батарея» в 1749 году, когда проводил эксперименты с электричеством с использованием набора соединенных конденсаторов.
Первая настоящая батарея была изобретена итальянским физиком Алессандро Вольта в 1800 году. Вольта сложил диски из меди (Cu) и цинка (Zn), разделенных тканью, пропитанной соленой водой.
Провода, подключенные к любому концу стопки, производили непрерывный стабильный ток. Каждая ячейка (набор из дисков Cu, Zn и рассола) производит 0.76 Вольт (В). Это значение, кратное этому значению, определяется количеством ячеек, сложенных вместе.
Одна из самых долговечных батарей, свинцово-кислотная, была изобретена в 1859 году и до сих пор используется в большинстве автомобилей с двигателями внутреннего сгорания. Это старейший образец аккумуляторной батареи.
Сегодня батареи бывают разных размеров от больших мегаваттных размеров, которые накапливают энергию солнечных ферм или подстанций, чтобы гарантировать стабильное энергоснабжение целых деревень или островов, до крошечных батарей, подобных тем, которые используются в электронных часах.
Батареиимеют различный химический состав, которые генерируют базовые напряжения элементов, как правило, в диапазоне от 1,0 до 3,6 В. Последовательное соединение ячеек увеличивает напряжение, а их параллельное соединение увеличивает подачу тока. Этот принцип используется для суммирования необходимых напряжений и токов вплоть до мегаваттных размеров.
В настоящее время многие ожидают, что технология аккумуляторов совершит еще один скачок с разработкой новых моделей, обладающих достаточной емкостью для хранения энергии, вырабатываемой домашними солнечными или ветряными системами, и затем для некоторых обеспечит подачу энергии в дом в более удобное (обычно ночное) время. дней
Как работают аккумуляторы?
Когда батарея разряжается, в результате химической реакции образуются дополнительные электроны.Примером реакции, в которой образуются электроны, является окисление железа с образованием ржавчины. Железо реагирует с кислородом и отдает электроны кислороду с образованием оксида железа.
Стандартная конструкция батареи заключается в использовании двух металлов или соединений с разными химическими потенциалами и разделении их с помощью пористого изолятора. Химический потенциал - это энергия, запасенная в атомах и связях соединений, которая затем передается движущимся электронам, когда им разрешается перемещаться через подключенное внешнее устройство.
Проводящая жидкость, такая как соль и вода, используется для переноса растворимых ионов от одного металла к другому во время реакции и называется электролитом.
Металл или соединение, которое теряет электроны во время разряда, называется анодом, а металл или соединение, которое принимает электроны, называется катодом. Этот поток электронов от анода к катоду через внешнее соединение - это то, что мы используем для работы наших электронных устройств.
Первичные и аккумуляторные батареи
 Типичный автомобильный аккумулятор.Предоставлено: Flickr / Асим Бхарвани, CC BY-NC-ND.
Типичный автомобильный аккумулятор.Предоставлено: Flickr / Асим Бхарвани, CC BY-NC-ND. Когда реакция, которая вызывает поток электронов, не может быть обращена вспять, батарея называется первичной батареей. Когда один из реагентов израсходован, батарея разряжена.
Наиболее распространенной первичной батареей является угольно-цинковая батарея. Было обнаружено, что, когда электролитом является щелочь, батареи служат намного дольше. Это щелочные батареи, которые мы покупаем в супермаркете.
Проблема утилизации таких первичных батарей заключалась в том, чтобы найти способ их повторного использования путем подзарядки батарей.Это становится более важным по мере того, как батареи становятся больше, и частая их замена коммерчески нецелесообразна.
Одна из первых аккумуляторных батарей, никель-кадмиевая батарея (NiCd), также использует щелочь в качестве электролита. В 1989 году были разработаны никель-металл-водородные батареи (NiMH), которые имели более длительный срок службы, чем никель-кадмиевые батареи.
Батареи этого типа очень чувствительны к перезарядке и перегреву во время зарядки, поэтому скорость заряда контролируется ниже максимальной.Сложные контроллеры могут ускорить зарядку, не занимая меньше нескольких часов.
В большинстве других более простых зарядных устройств процесс обычно занимает всю ночь.
Портативные приложения, такие как мобильные телефоны и портативные компьютеры, постоянно ищут максимальную и максимально компактную накопленную энергию. Хотя это увеличивает риск сильной разрядки, с этим можно справиться с помощью ограничителей скорости тока в аккумуляторах мобильных телефонов из-за их малого формата.
Но по мере того, как рассматриваются более крупные применения батарей, безопасность большого формата и большого количества элементов становится более важным соображением.
Первый большой скачок вперед: литий-ионные батареи
Новые технологии часто требуют более компактных, более емких, безопасных перезаряжаемых батарей.
В 1980 году американский физик профессор Джон Гуденаф изобрел новый тип литиевой батареи, в которой литий (Li) мог мигрировать через батарею от одного электрода к другому в виде иона Li +.
Литий - один из самых легких элементов в периодической таблице Менделеева и имеет один из самых больших электрохимических потенциалов, поэтому эта комбинация дает одни из самых высоких возможных напряжений в самых компактных и легких объемах.
Это основа литий-ионного аккумулятора. В этой новой батарее литий сочетается с переходным металлом, таким как кобальт, никель, марганец или железо, и кислородом, образуя катод. При подаче напряжения во время перезарядки положительно заряженный ион лития с катода мигрирует на графитовый анод и становится металлическим литием.
Поскольку литий обладает сильной электрохимической движущей силой, которая должна окисляться, если это разрешено, он мигрирует обратно на катод, чтобы снова стать ионом Li +, и отдает свой электрон обратно иону кобальта.Движение электронов в цепи дает нам ток, который мы можем использовать.
Второй большой скачок вперед: нанотехнологии
В зависимости от переходного металла, используемого в литий-ионном аккумуляторе, элемент может иметь более высокую емкость, но может быть более реактивным и подверженным явлению, известному как тепловой разгон.
В случае литий-кобальтовых батарей (LiCoO 2 ), произведенных Sony в 1990-х годах, это привело к возгоранию многих таких батарей.О возможности изготовления аккумуляторных катодов из наноразмерного материала и, следовательно, более реактивного материала не могло быть и речи.
Но в 1990-х годах Гуденаф снова совершил огромный скачок в технологии аккумуляторов, представив стабильный литий-ионный катод на основе литий-железа и фосфата.
Этот катод термически устойчив. Это также означает, что наноразмерные материалы из фосфата лития-железа (LiFePO 4 ) или феррофосфата лития (LFP) теперь можно безопасно превращать в крупноформатные элементы, которые можно быстро заряжать и разряжать.
Сейчас для этих новых ячеек существует множество новых применений, от электроинструментов до гибридных и электромобилей. Возможно, наиболее важным применением будет хранение бытовой электроэнергии для домашних хозяйств.
Первый мобильный телефон имел большую батарею и короткое время автономной работы - современные мобильные телефоны и смартфоны требуют меньших батарей, но более продолжительного заряда.
Электромобили
Лидером в производстве аккумуляторных батарей нового формата для транспортных средств является компания Tesla, занимающаяся электромобилями, которая планирует построить «гига-заводы» для производства этих аккумуляторов.
Размер литиевой аккумуляторной батареи для Tesla Model S составляет впечатляющие 85 кВтч.
Этого также более чем достаточно для бытовых нужд, поэтому было так много слухов относительно того, что основатель Tesla Илон Маск готовится раскрыть на этой неделе.
Модульная конструкция батареи позволяет создавать батареи, которые в некоторой степени взаимозаменяемы и подходят как для автомобилей, так и для бытовых применений без необходимости переделки или реконструкции.
Возможно, мы вот-вот станем свидетелями следующего поколения изменений в производстве и хранении энергии, обусловленного постоянно улучшающимися возможностями скромной батареи.
Помимо литий-ионных аккумуляторов - значительный шаг к более производительной батарее
Эта история любезно опубликована The Conversation (по лицензии Creative Commons-Attribution / Без производных).
Ссылка : История и развитие батарей (2015, 30 апреля) получено 3 ноября 2020 с https: // физ.org / news / 2015-04-history-battery.html
Этот документ защищен авторским правом. За исключением честных сделок с целью частного изучения или исследования, нет часть может быть воспроизведена без письменного разрешения. Контент предоставляется только в информационных целях.
.проблем со здоровьем, связанных с аккумуляторами - Battery University
Узнайте, что можно и чего нельзя делать при обращении с аккумуляторами.
Батареи безопасны, но необходимо соблюдать осторожность при прикосновении к поврежденным элементам и при работе со свинцово-кислотными системами, имеющими доступ к свинцу и серной кислоте. В некоторых странах свинцовую кислоту называют опасным материалом, и это правильно. Свинец может быть опасен для здоровья при неправильном обращении.
Свинец
Свинец - это токсичный металл, который может попасть в организм при вдыхании свинцовой пыли или проглатывании при прикосновении к рту руками, загрязненными свинцом.При попадании на землю частицы кислоты и свинца загрязняют почву и при высыхании переносятся по воздуху. Дети и плоды беременных женщин наиболее уязвимы для воздействия свинца, потому что их организм развивается. Избыточный уровень свинца может повлиять на рост ребенка, вызвать повреждение мозга, повредить почки, ухудшить слух и вызвать поведенческие проблемы. У взрослых свинец может вызвать потерю памяти и снизить способность к концентрации внимания, а также нанести вред репродуктивной системе. Также известно, что свинец вызывает высокое кровяное давление, нервные расстройства, боли в мышцах и суставах.Исследователи предполагают, что Людвиг ван Бетховен заболел и умер из-за отравления свинцом.
| К 2017 году члены Международной ассоциации свинца (ILA) хотят поддерживать уровень свинца в крови рабочих горнодобывающих, плавильных, нефтеперерабатывающих и перерабатывающих предприятий на уровне ниже 30 микрограммов на децилитр (30 мкг / дл). В 2014 году средний участвующий сотрудник приходил на прием при 15,6 мкг / дл, но 4,8% были выше 30 мкг / дл. (Source Batteries & Energy Storage Technology, лето 2015.) В 2019 году Университет Южной Калифорнии опубликовал данные об обнаружении свинца в зубах детей, живущих рядом с заводом по переработке батарей Exide Technologies в Верноне, штат Калифорния. | Рисунок 1: Свинец обнаружен в зубах младенцев возле завода по переработке аккумуляторов. |
Свинец содержится в почве в естественных условиях на уровне 15–40 мг / кг. Этот уровень может многократно увеличиваться вблизи заводов по производству и переработке свинцовых аккумуляторов.Уровни загрязнения почвы свинцом в развивающихся странах, в том числе на африканском континенте, составляют 40–140 000 мг / кг. (См. BU-705: Как утилизировать батареи.)
Серная кислота
Серная кислота в свинцово-кислотных аккумуляторах очень агрессивна и более вредна, чем кислоты, используемые в большинстве других аккумуляторных систем. Попадание в глаза может вызвать необратимую слепоту; глотание повреждает внутренние органы, что может привести к летальному исходу. При оказании первой помощи необходимо промывать кожу в течение 10–15 минут большим количеством воды, чтобы охладить пораженные ткани и предотвратить вторичное повреждение.Немедленно снимите загрязненную одежду и тщательно промойте подлежащую кожу. При обращении с серной кислотой всегда надевайте защитное снаряжение.
Кадмий
Кадмий, используемый в
.Практические соображения - Аккумуляторы | Аккумуляторы и системы питания
- Сетевые сайты:
-
- Последний
- Новости
- Технические статьи
-
- Последний
- Проектов
- Образование
-
- Последний
- Новости
- Технические статьи
- Обзор рынка
- Образование
-
- Последний
- Новости
- Мнение
- Интервью
- Особенности продукта
- Исследования
- Форумы
- Авторизоваться
- Присоединиться
- Авторизоваться
- Присоединиться к AAC
-
Или войдите с помощью
-
0:00 / 0:00
- Подкаст
- Самый последний
- Подписывайся
- Spotify










 Copyright ©
Copyright ©